Massa atômica e massa molecular
A Massa atômica (u) é o padrão utilizado para se medir o peso dos átomos esta padronização foi necessária devido ao átomo ser extremamente leve.
Massa atômica
A Massa atômica (u) é o padrão utilizado para se medir o peso dos átomos esta padronização foi necessária devido ao átomo ser extremamente leve.
Massa atômica dos elementos

A Massa atômica do Oganesson é 294 u
O parâmetro utilizado é o carbono, onde a unidade atômica tem 1/12 avos do carbono, ou seja, 1,66 * 10-24g
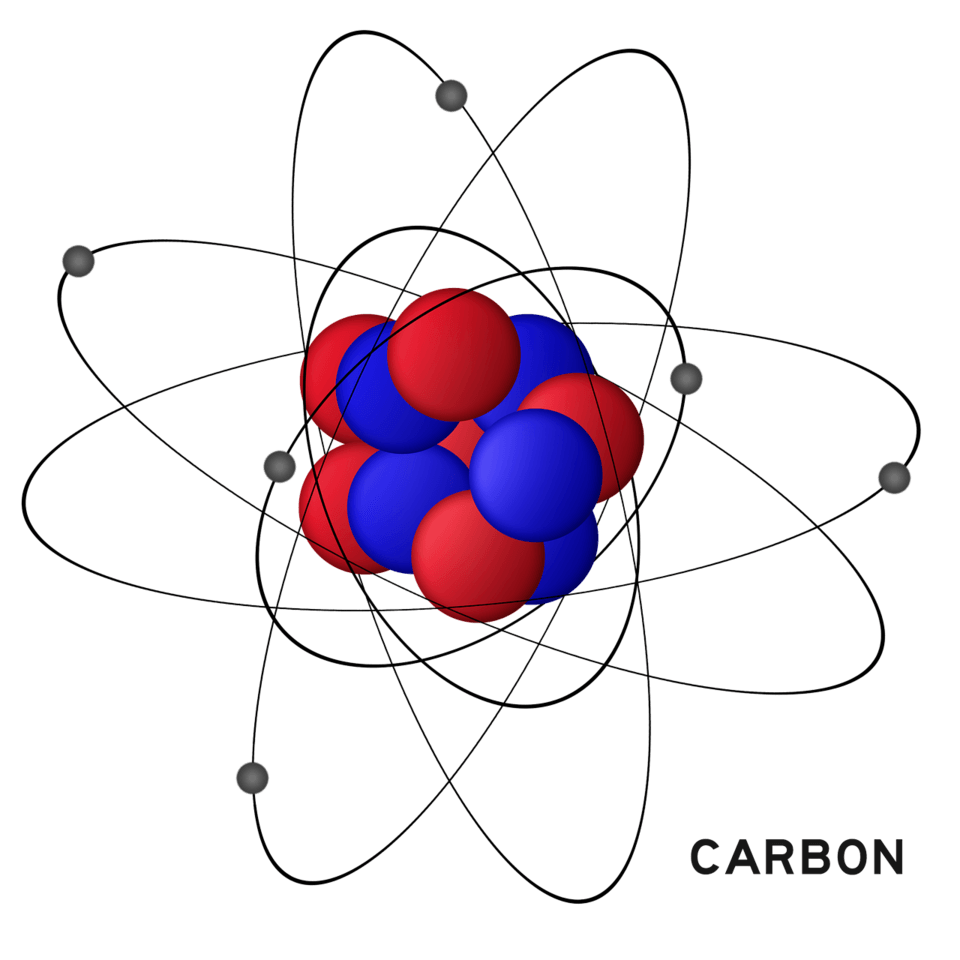
1u = 1/12 avos do carbono, ou seja, 1,66054 . 10-24g.
Confira alguns exemplos das massas atômicas do elementos da tabela periódica
- Alumínio (Al) - 26,988 u
- Bário (Ba) - 137,327 u
- Cádmio (Cd) - 112,411 u
- Cloro (Cl) - 35,453 u
- Hélio (He) - 4,002 u
- Índio (In) - 114,818 u
- Magnésio (Mg) - 24,305 u
Como é realizado o cálculo da massa?
A massa atômica dos elementos químicos é o resultado da média ponderada dos seus isótopos.
Utilizando o Ferro como exemplo, conforme mostra a tabela:
| Massa do isótopo | Abundância (%) |
|---|---|
| 54 | 5,85 |
| 56 | 91,754 |
| 57 | 2,12 |
| 58 | 0,28 |
1. Primeiro se multiplica a massa pela abundância do isótopo:
Isótopo 54: 54 x 5,85 = 315,9
Isótopo 56: 56 x 91,754 = 5138,224
Isótopo 57: 57 x 2,12 = 120,84
Isótopo 58: 58 x 0,28 = 16,24
2. Depois vamos somar os resultados obtidos:
Valor = 315,9 + 5138,224 + 120,84 + 16,24
Resultado = 55391,204
3. Agora vamos dividir o resultado por 100
Massa Atômica = 55391,204/100 = 55,91204 u
Agora você já sabe descobrir as massas atômicas, como a do Ferro que é 55,91204 u
Massa Molecular
Para encontrar a massa molecular é muito simples, basta multiplicar a quantidade de moléculas pela massa do elemento.
Vamos encontrar a massa da água
A sua fórmula é H2O
Água = H2O
Massa: (H=1); (O=16)
H2O = 2x1 + 1x16 = 18u
Acetona = C3H6O
Massa: (H=1); (C=12); (O=16)
C3H6O = 3x12 + 6x1 + 1x16 = 58u
Dopamina= C8H11NO2
Massa: (H=1); (C=12); (O=16); (N=14);
C8H11NO2 = 8x12 + 11x1 + 1x14 + 2x16 = 153u
Caso Especial
Fosfato de cálcio = Ca3(PO4)2
Massas atômicas: (Ca = 40); (P = 31); (O = 16);
Fosfato de cálcio = Ca3(PO4)2 = (3 x 40) + (2 x 31) + (8 x 16) = 120 + 62 + 128 = 310 u
Repare que o 8 é multiplicado por 16, pois nesse caso, existe a multiplicação das 4 moleculas de Oxigenio (O) como o 2 que aparecem após o parêntese.