Geometria Molecular
A geometria molecular estuda a organização das moléculas que são constituídas por átomos dentro de uma espaço onde elas podem assumir diversas formas.

A geometria molecular estuda a organização das moléculas que são constituídas por átomos dentro de uma espaço onde elas podem assumir diversas formas.
Hoje vamos aprender sobre as principais classificações que são: linear, angular, trigonal plana, piramidal e tetraédrica, além de aprender como descobrir se a molécula é polar ou apolar.
Um ponto importante é que não abordaremos geometria bipiramidal e octaédrica, uma vez que raramente serão cobradas em vestibulares, dando foco assim ao que é necessário aprender.
VSEPR
A VSEPR é a Teoria de Repulsão dos Pares Eletrônicos da Camada de Valência, uma modelo criado para prever a geometria das moléculas. Segundo a teoria da VSEPR, os pares eletrônicos presentes na camada de valência do átomo central se repelem independente de estarem ou não compartilhados com outro átomo, e a depender do nível de afastamento, a molécula tem dada geometria.
Para CISCATO et al. (2016, p. 130 e 131) a VSEPR é baseada nas seguintes regras:
Os pares de elétrons se repelem e, para reduzir ao máximo essa repulsão, tendem a se afastar o máximo possível, mantendo a mesma distância do átomo central.
São considerados como um único par de elétrons – sem distinção: ligação covalente simples, ligação covalente dupla, ligação covalente tripla ou par de elétrons não ligantes (par de elétrons da camada de valência do átomo central que não participa de ligações).
Quando existe mais de um átomo central, as ligações de cada átomo são tratadas independentemente.
Tipos de Geometria Molecular
1. Geometria Molecular: Linear
Ângulo de 180°
Número de Ligações: 1 ou 2
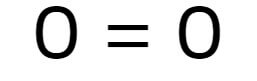
O2 (Oxigênio)
Mais simples de todas, podendo ter 2 ou 3 átomos.
Tendo dois átomos, e não existindo um átomo central, então é linear, uma vez que estão retos.
Exemplos de moléculas biatômicas
1. HCl (Ácido clorídrico)
2. CO2 (Gás carbônico)
3. C2H2 (Acetileno)
Tendo três átomos, é linear caso o átomo central não tenha pares que não estejam fazendo ligações.
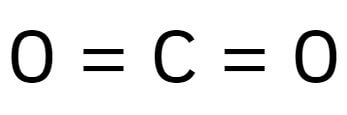
CO2 (Gás carbônico)
2. Geometria Molecular: Angular
Ângulo de 104°
Número de Ligações: 2
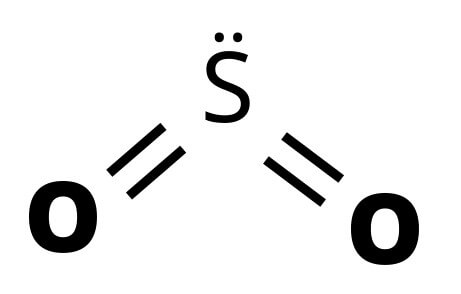
SO2 (Dióxido de enxofre)
Na Geometria molecular angular as moléculas são triatômicas, ou sejam três átomos. Sendo que o elemento central possui par de elétrons livres.
Exemplos de moléculas triatômicas
1. H2O (Água)
2. SO2 (Dióxido de enxofre)
3. O3 (Ozônio)
3. Geometria Molecular: Trigonal Plana
Ângulo de 120°
Número de Ligações: 3
É formada por 3 ligações no átomo central, e não existe par de elétrons livres no mesmo.
H₂SO₄ Ácido sulfúrico
Exemplos: Trigonal Plana
1. BH3 (Borano)
2. SO3 (Óxido sulfúrico)
3. NO3- (Nitrato)
4. BF3 (Trifluoreto de boro)
4. Geometria Molecular: Piramidal
Ângulo de 107°
Número de Ligações: 3
É formada por quatro átomos, com um total de 3 ligações, sendo que o átomo central tem par de elétrons livres
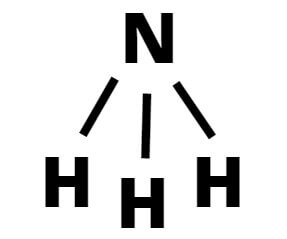
NH3 (Amoníaco)
Exemplos: Piramidal
1. ClO3- (Clorato)
2. PCl3 (Tricloreto de fósforo)
3. NH3 (Amoníaco).
5. Geometria Molecular: Tetraédrica
Ângulo de 109°
Número de Ligações: 4
É a única que é formada por cinco átomos, além do fato de que o elemento central não tem par de elétrons.
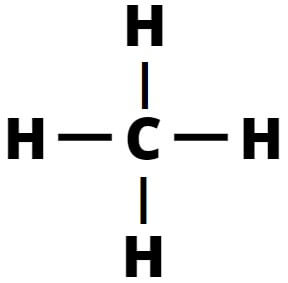
CH4 (Metano)
Exemplos: Tetraédrica
1. CH4 (Metano)
2. NH4 (amônio)
Polaridade das moléculas
Existem várias formas de descobrir se uma molécula é polar ou apolar, como por exemplo, a soma dos vetores. Porém seguir essa lógica pode facilitar a sua vida.
Se a geometria molecular for Angular ou Piramidal então a molécula é polar.
Se a geometria molecular for diferente da Angular ou Piramidal é os ligantes forem iguais, então a molécula é apolar.
Agora, se os ligantes forem diferentes, então a molécula é polar.
Lista Geral de Questões
Vestibular: Geometria Molecular I
Vestibular: Geometria Molecular II
Referências:
Química – CISCATO, Carlos; PEREIRA, Luis; CHEMELLO, Emiliano; e PROTI, Patrícia; 1. ed. — São Paulo: Moderna, 2016.